从腺相关病毒(Adeno-Associated Virus, AAV)的研究到腺相关病毒载体的开发,这个历程已经超过了三十年。
AAV载体目前已经广泛应用治疗多种单基因疾病的临床试验,包括靶向眼睛、神经肌肉、肝脏和中枢神经系统等靶器官的多项临床研究,这些临床试验数据证明了以AAV载体进行进行基因治疗的安全性和有效性。过去的基因治疗主要集中在基因替换上,通过AAV载体把序列正确的基因递送到组织中表达以替换发生了突变而没有蛋白功能的基因。目前为了适应新的临床模式,研究人员正在通过RNAi和基因修饰策略如CRISPR/cas9来开发AAV载体系统。
虽然多项研究展示了AAV载体作为基因治疗的光明前景,然而,AAV载体系统中仍有许多未解决的问题。比如AAV载体在人体内引发的T细胞反应、靶基因被递送之后由于机体细胞的有丝分裂,其表达和持续性受到影响、AAV载体进入人体可能诱发的毒性作用以及AAV载体和细胞之间的相互作用等,这些都是目前存在的未得到很好解答的问题。在这里,我们回顾其中的一些领域,寻找解决这些的可能路径。
AAV的免疫性
根据人类血清学的研究结果,已知健康人群广泛存在AAV的感染。发现在人体中AAV中和抗体携带率很高,例如AAV1 感染超过60%人群,AAV2 感染超过80%人群。在呼吸道腺病毒感染中,在上呼吸道组织中发现了感染的野生型AAV。是否所有感染都需要呼吸道飞沫传播,或者是通过其他感染途径例如胃肠道来实现,这些感染的具体细节在很大程度上仍然未知。针对特定AAV血清型的抗体水平的研究相对较少,不过在进行临床试验之前,需要了解受试者体内是否存在对AAV载体作用的血清型抗体以及可能的影响,即受试者体内预先存在的中和抗体会对体内基因治疗的临床试验产生怎样的影响。
一种策略是对受试者进行筛选,这种情况大部分患者可能被排除出临床试验。另外一种策略是为了让更多的患者得到参加临床试验的机会,开发能够“逃避”中和抗体的AAV载体衣壳蛋白。
开发“逃避”中和抗体的AAV载体衣壳蛋白,对原先衣壳蛋白上的抗原位点表位进行改造,设计出抗原性低的病毒载体结合的表位,这样可以逃避人群中免疫细胞预先存在的中和抗体对AAV载体的识别。由于AAV在进化上非常古老,有可能从其它一些古老物种中分离到其它血清型的AAV,这种AAV可能不含有人类接触过的抗原表位,可以作为新一代的AAV载体来分析测试。
整体而言,在整个AAV家族中,有一些区域高度保守,比如pH四重组区域,该区域包含一个蛋白酶位点和一个转录调控位点,对不同血清型AAV和单克隆抗体的交叉反应起着重要的作用,因此对新的AAV血清型的分离和改造是一个大的挑战。
有研究者利用细菌中发现的酶IdeS和IdeZ,在使用AAV产品之前使用这些酶,IdeS和IdeZ在短时间内降解人体中预存的抗AAV中和抗体,这样创造了一个时间窗口给AAV载体到达靶组织和目的细胞。总而言之,人体中预存的免疫原性是AAV载体产品给药和基因疗法的突出问题。
AAV免疫性的另外一个问题是如何降低人体免疫系统对AAV载体的免疫应答。目前已经知道野生型AAV感染人类之后,将导致免疫系统对该病毒启动体液介导的先天性免疫和T细胞应答的适应性免疫(图一)。
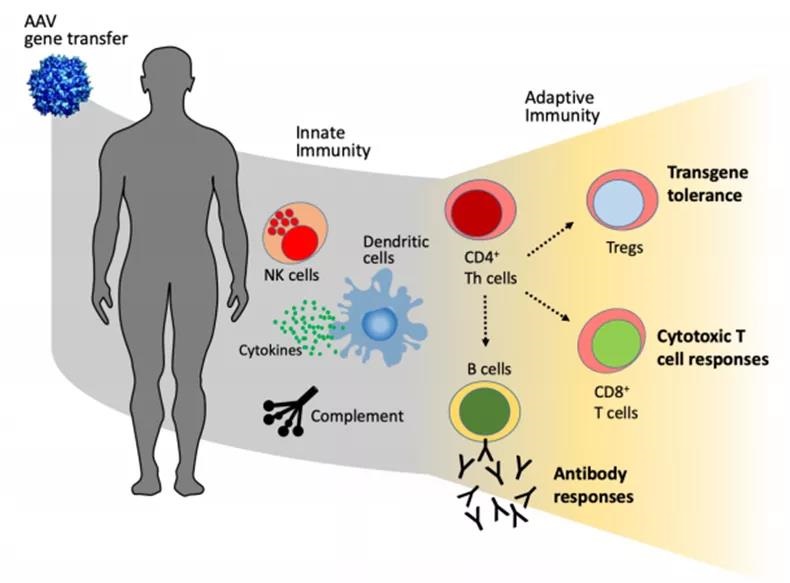
图一(来源:参考文献1)
先天性免疫反应通过免疫细胞表面或内部表达的模式识别受体PRR (Pattern recognition receptors, PRR),比如Toll样受体9 (Toll-like receptor 9, TLR9) 来识别AAV病原体上的病原体相关分子模式 (Pathogenassociated molecular patterns, PAMPs),从而启动先天性免疫应答。
PRRs识别AAV的核酸DNA和衣壳蛋白后,激活NF-κB和IRF干扰素调节因子,诱导产生促炎细胞因子和I型干扰素IFN,从而产生免疫应答。在适应性免疫应答中,T淋巴细胞和B淋巴细胞被激活后,识别抗原递呈细胞APCs提供的AAV抗原,通过T细胞毒性反应消除抗原。
有研究表明,AAV反向末端重复序列ITR可能参与了TLR9对AAV DNA的反应(图二)。需要了解AAV上哪些ITR序列对AAV是必不可少的,通过改造AAV的ITR序列,比如在某些GC富集区域改变GC的含量,优化AAV载体的ITR序列,降低或者避免人体免疫系统对AAV载体给药的免疫应答,使得递送的目的基因正确表达,从而保证给药和治疗的效果。

图二(来源:参考文献4)
AAV的持久性
AAV建立持续感染后会产生什么后果目前未知。在动物模型研究中,AAV载体主要作为染色体外的元件存在于组织中,几乎很少整合到动物组织的基因组中。从人体扁桃体和腺样体组织中分离到的野生型AAV,也主要以游离的形式存在,野生型AAV的基因组以环状从头对尾串联。到目前为止,只有个别研究报道提到了野生型AAV整合到人体基因组中。
尽管已知人群中广泛存在AAV的特异性抗体,但没有关于自然感染后AAV持续的时间及频率的相关数据。在腺相关病毒感染后的短时间内,在上呼吸道的上皮细胞、扁桃体和腺样组织、泌尿生殖道组织和人类白细胞等不同组织细胞中,能检测到野生型AAV基因组DNA的存在. 如果野生型AAV基因组DNA持续存在,需要什么样的条件来维持或者持续的时间怎样,目前所知不多。
目前仍然不清楚AAV载体维持它持续性表达的具体原因和机制。在实验室中将环状表达质粒转染到动物模型中,一般仅能实现短暂的稳定表达。然而,研究表明AAV载体将在动物体内持续表达目的基因长达6-12个月,甚至有些研究结果显示AAV载体在眼睛、大脑和肌肉等多种不同器官组织中持续有增无减地表达长达12年。研究显示AAV载体的反向末端重复序列ITR可能存在某种信号防止染色质被修饰关闭并促进质粒持续稳定表达。因此研究清楚AAV载体基因组DNA持久性表达的机制对于基因疗法中精确调控目的基因特异性表达及表达水平对治疗效果有着重要作用。
AAV的毒性
有个别研究报道了AAV感染某些突变系的新生小鼠,可能增加肝癌发病的风险。不过,目前的研究表明,绝大多数被AAV (野生型AAV或者AAV载体) 感染的小鼠,实验结果并未显示其增加了肿瘤发生的概率。
和常规认识的印象相反,有研究报道称AAV可能会抑制肿瘤的发生。研究显示,AAV基因组DNA的ITR 序列能够诱导修复途径,导致肿瘤细胞系凋亡,对人乳头瘤病毒有一定的抑制能力,从而抑制宫颈癌的发生。在动物模型研究中,当输入AAV时,AAV转导和注射部位会发生细胞凋亡,引起急性毒性事件。由于实验中同时使用对照载体和AAV载体,当达到某个相同的输入剂量时,所有的构建体(对照载体和AAV载体)都观察到了毒性,这表明不是目的基因而是载体的某些方面导致了毒性事件的发生。目前研究结果比较明显的是,使用AAV载体转导胚胎干细胞是有毒的。长期以来认为AAV和AAV载体不会有毒的观点并不一定适用于特殊条件下的基因治疗试验。AAV载体本身、剂量以及递送基因,这些因素需要进行研究清楚具体的毒性影响及其背后的作用机制。
AAV和细胞的相互作用
AAV 伊始被发现的时候,由于其基因组很小一度被当作一种有趣的模型病毒,认为其通过简单策略运行生命周期。目前研究表明,为了延续其基因组,AAV使用更加精巧和聪明的策略来复制和延续其 DNA,执行类似大病毒的所有功能。伊始,AAV基因组被认为在基因组左半部分的读码框中编码四种非结构蛋白,在右半部分的读码框中编码三种结构衣壳蛋白。研究结果表明,非编码RNA可以从AAV转录,AAV基因组的反义转录和翻译可能在细胞基因表达中发挥作用。关于 AAV和细胞相互作用的大部分工作都集中在鉴定参与AAV基因组DNA复制的蛋白质和与AAV启动子区域结合的转录因子。然而,对于AAV 与细胞中各种关联蛋白质的相互作用仍然所知不多。随着蛋白质组学技术应用于AAV研究中,已经确定了许多蛋白质,它们参与减弱AAV病毒产量并可能参与AAV组装。这些问题的解答有助于产生改进的AAV载体、提高转导效果以及之后AAV载体的大规模生产,都有着非常重要的作用。AAV正逐渐成为分子生物学研究和临床基因治疗中的一种非常有希望的工具。
小结:
在这篇文章里,主要梳理了AAV载体及其目前存在的技术瓶颈。可以发现,AAV载体免疫原性是剂量依赖性,先天性免疫应答机制对基因转移的效果起着重要作用以及宿主特异性因素将有助于对AAV载体免疫原性机制的理解;AAV载体的反向末端重复序列ITR中存在的多个转录元件结合位点以及基因组表观修饰可能对质粒的持久表达存在某种调控信号;AAV载体对机体的毒性程度以及抑制癌症发生的机制仍需进一步研究;对AAV载体和细胞之间的相互作用所知不多,这些都是当前存在的技术瓶颈问题。AAV载体从科研到CDMO到多种疾病基因疗法的临床试验,各项研究方兴未艾。利用智能化和工程化的手段来改造AAV载体系统,共同努力解决上述挑战,将更好迎接基因治疗时代的到来。
参阅文献
1. Helena Costa Verdera, Klaudia Kuranda, Federico Mingozzi. AAV Vector Immunogenicity in Humans: A Long Journey to Successful Gene Transfer. Molecular Therapy. 2020, 28(3):723-746.
2. Dan Wang, Phillip W L Tai, Guangping Gao. Adeno-associated virus vector as a platform for gene therapy delivery. 2019, 18(5):358-378.
3. Kenneth I. Berns, Nicholas Muzyczka. AAV: An Overview of Unanswered Questions. Human Gene Therapy. 2017, 28(4): 308–313.
4. Chengwen Li, R Jude Samulski . Engineering adeno-associated virus vectors for gene therapy. Nature Reviews Genetics. 2020, 21(4): 255-272.
该文章来自于网络转载,版权归原作者所有。如有涉及侵权请告知,我们将尽快删除相关内容。




