腺相关病毒载体介导的感染效率比真核表达质粒的要高,且目的基因表达稳定,目前已经被广泛应用于体外细胞和体内动物实验中目的基因的功能研究、模型建立和临床试验等。越来越多实验室的课题都要用到AAV病毒包装,不过在实验的过程中会出现很多问题,比如载体构建、质粒抽提纯化异常、病毒滴度过低甚至出不了毒等等情况。今天来聊聊这方面的问题,看看病毒包装高质量的交付受到哪些因素影响,怎样能做得更好。
Q1:腺相关病毒是什么?和实验室用的AAV载体的区别在哪里?
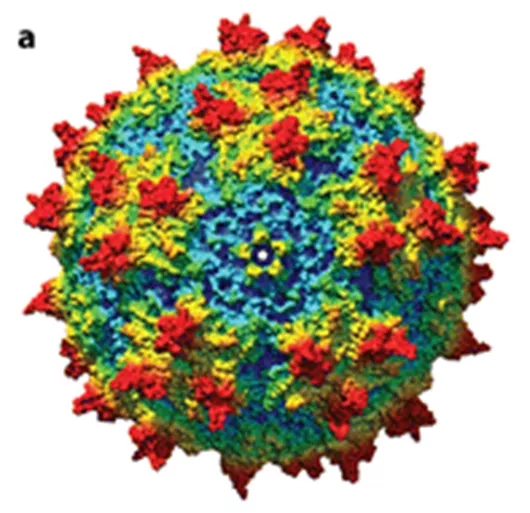
答:腺相关病毒,即Adeno-Associated Virus (AAV), 是自然界中存在的天然病毒,基因组上有rep基因和cap基因,因此也叫野生型腺相关病毒(图一),即wide type AAV(wtAAV);实验室用的AAV载体,是在腺相关病毒的基础上经过人工改造的质粒,基因组上没有rep基因和cap基因,因此也叫重组腺相关病毒,即recombinant AAV(rAAV)。 没有特别指出的时候,简称AAV一般是指已经改造过的AAV载体。
图一(来源:参考文献1)
Q2:腺相关病毒有哪些特点,AAV适合做哪些下游实验?
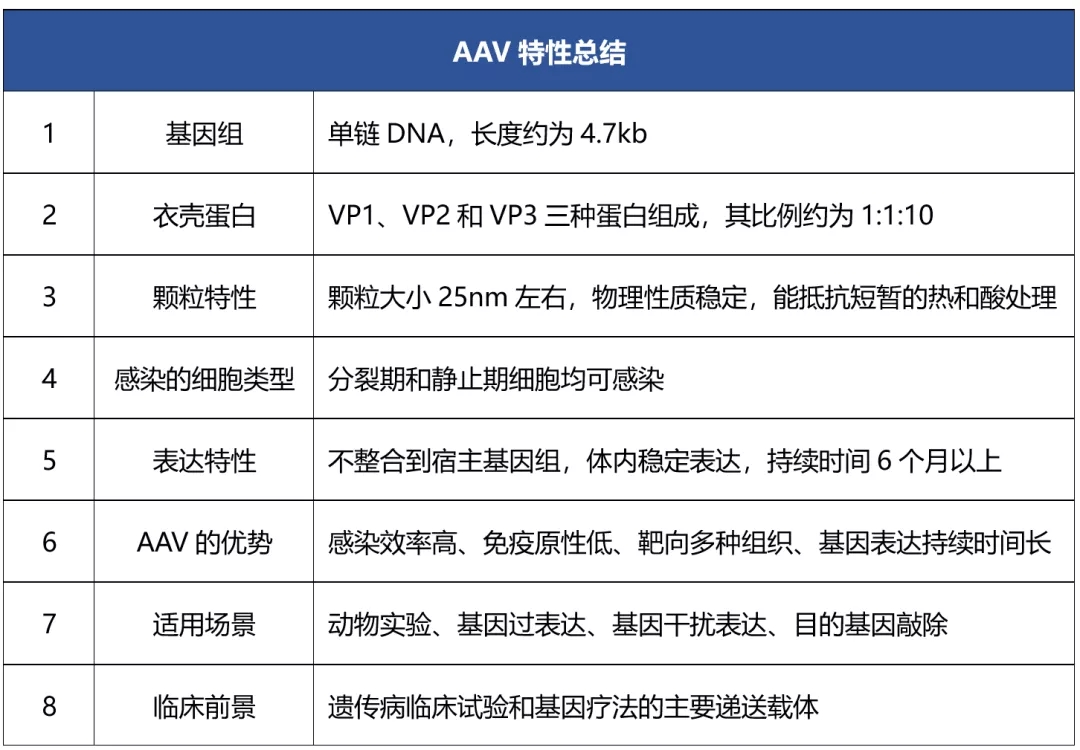
答:腺相关病毒是一种小型无包膜病毒,属于细小病毒科,包含一个单链线性DNA基因组,长度约为4.7kb,其衣壳蛋白由VP1、VP2和VP3三种蛋白构成,在1965年从腺病毒分离株的污染物中首次被发现。
Q3. 腺相关病毒进入宿主细胞之后,其基因组会整合到宿主细胞基因组中吗?
答:野生型腺相关病毒wtAAV感染人体细胞后,由于其rep基因、ITR序列结构和宿主基因组的相互作用,可能倾向整合到19号染色体短臂上的AAVS1位点,在小鼠中是倾向整合到ROSA26基因位点;而改造过的重组型腺相关病毒rAAV,由于基因组上已经去除了rep和cap基因,因此失去了整合到宿主基因组的特性。rAAV在体内组织,特别是在肌肉组织中,在宿主基因组染色体以外以附加子(episome)的双链DNA形式存在,持续稳定表达目的基因。
Q4. 怎样实现AAV在动物体内稳定持续表达?
答:从以下几个方面进行优化以顺利实现AAV在动物体内的持续稳定表达。
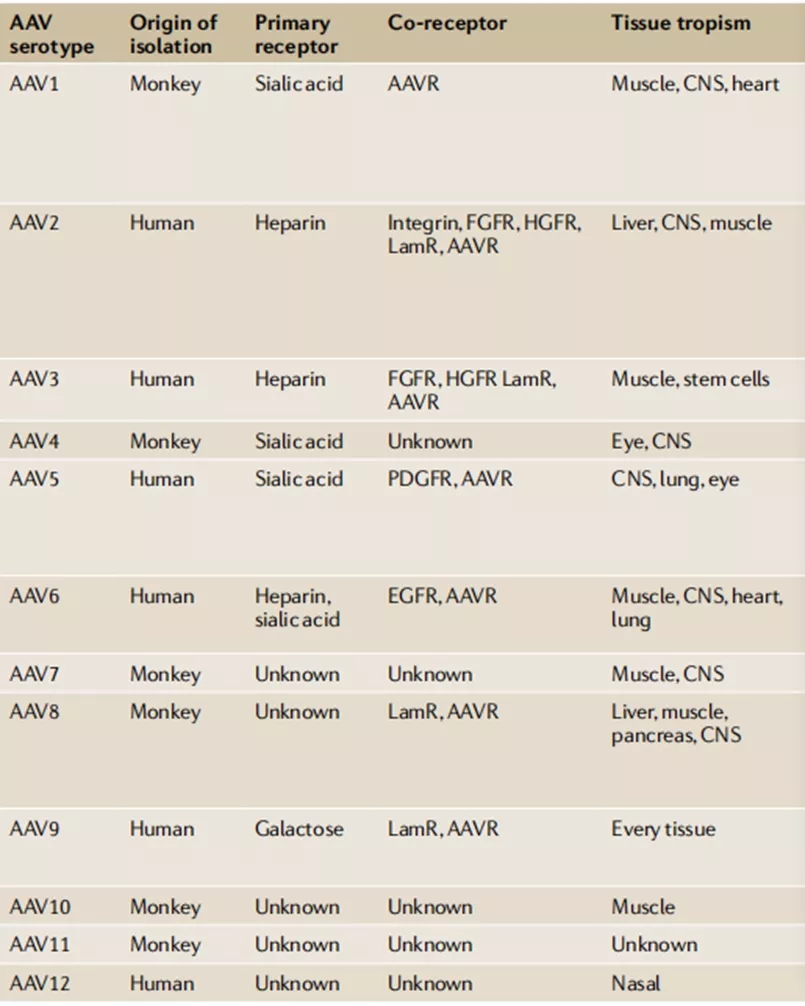
1)不同的血清型AAV对组织有偏向性,即在靶组织里面表达更稳定(图二)。根据文献已经报道的结果和自身课题实验设计,选择合适的血清型AAV,通过细胞表面特异性受体感染细胞,提高转染效率;研究深入之后,可以对衣壳蛋白进行合理设计、定向进化和计算机辅助设计来筛选获得突变型的衣壳蛋白,在靶向组织特异性和表达水平持续性上进行不断改善。
图二(来源:参考文献4)
2)根据研究的目的基因和感染的靶器官组织类型,选择合适的启动子。广谱型的启动子有:CMV、CAG、CBG和EF1a;如果靶向中枢神经系统星形胶质细胞,可以选择GFAP和shortGFAP启动子;如果想在肝脏中特异表达,选择TBG、ALB或者ApoEHCR-hAAT作为启动子,增强组织靶向性效果更好。
3)注意使用合适的AAV病毒量和滴度,感染动物时AAV病毒用量不是越多越好,当用量太多,由于病毒溢出效应的影响,目的基因的表达量反而降低。
4)对靶器官进行局部多点注射,使得AAV载体目的基因就近表达,表达效果和特异性更好。
Q5. AAV病毒载体对目的基因的大小是否有要求?
答:AAV载体的总容量是4.7kb左右(图三),由于载体中固有的启动子序列、PolyA序列以及两个ITR序列,这三个元件的序列总和在1200bp左右,同时可能还带有荧光标记或者抗性标记序列。所以AAV载体携带目的基因的时候,目的基因的长度建议不超过3kb。
图三(来源:参考文献3)
Q6. AAV在动物体内的表达量比体外细胞高的原因是?
答:由于AAV的基因组是单链DNA,进入细胞后需经过由单链变成双链的过程,才能开始转录翻译。体外培养的细胞体系中如果没有辅助病毒或者辅助因子的情况下,这种DNA单链转变成DNA双链的过程非常缓慢,所以目的基因表达滞后;而AAV注射进动物体内之后,靶器官组织里的各种辅助因子相对丰富,有助于AAV在体内快速表达,表达水平和持续时间更加稳定。
Q7. 为什么说AAV病毒载体适合做动物实验?
答:1)AAV的感染效率高于慢病毒LV,而其免疫原性低于腺病毒ADV;
2)利用不同血清型的AAV,能特异靶向神经系统、眼睛、肌肉和肝脏等多种不同类型的器官组织;
3)转导途径简便,浓缩好的病毒可以直接多点注射靶器官;
4)可以在体内稳定持续表达6个月以上,满足多种实验验证要求。
Q8. 在动物实验中,需要注射多少总量的AAV病毒载体?
答:研究AAV介导的外源基因功能,进行动物体内实验,根据动物实验低剂量、中剂量和高剂量的分组,AAV的病毒总量用量约为1x1011VG/Kg、1x1012VG/Kg和1x1013VG/Kg.
Q9. 用于动物体内实验的AAV病毒,是否需要纯化与浓缩?
答:很有必要,AAV病毒的纯化和浓缩是病毒包装中的必需步骤。细胞裂解液中含有大量的病毒衣壳蛋白、宿主细胞碎片、血清和细胞毒素等多种成分,这些杂质如果直接被注入动物体内,会导致宿主强烈的免疫反应。如果病毒滴度太低,达不到感染特定靶器官组织的目的。因此AAV载体经过纯化和浓缩之后,有利于后续动物体内实验顺利进行。具体详情可点击查看:关于AAV载体空壳率,你想了解的这里总结好了
Q10. AAV实验的安全注意事项?
答:虽然AAV载体目前已经被全世界学术界和工业界广泛使用,没有报道过意外,但不排除有可能存在未知的潜在风险。AAV载体的实验操作要在符合生物安全防护等级二级实验室资质(Biosafety laboratory-2, BSL-2)的实验室中进行,在实验室专门区域进行,避免产生气溶胶。每次实验后,需要对所有接触过AAV病毒载体的实验器具进行消毒处理。装有AAV载体的培养瓶,需标明危险品。对实验室的成员进行安全培训和风险提示。
Q11. 实验的时候怎么稀释病毒,有哪些注意事项?
答:根据实验要求,可以用PBS溶液、生理盐水或者完全培养基将病毒稀释到所需要的滴度。使用时,将病毒样本放置在冰浴上效果更好,稀释好的病毒样本尽量一次性用完。
Q12. 表示病毒滴度的单位有哪些?
答:重组病毒的滴度有多种单位表示,这些表示形式的不同主要是由于病毒载体本身的生物学特点不同、不同的测定方法以及过去使用约定俗成的习惯造成的。
1)TU/mL是Transduction Unit/mL的缩写,转导单位,多用于慢病毒载体;
2)PFU/mL是Plaque Forming Unit/mL的缩写,指噬菌斑形成单位,常用于腺病毒载体和单纯疱疹病毒载体;
3)VG/mL是Vector Genomes/mL的缩写,是指每mL病毒液中含有的基因组拷贝总数,一般用于表示AAV腺相关病毒载体的滴度。
Q13. 转染效率很低,怎么办?
答:AAV转染的时候,需要保证细胞生长状态良好、合适的细胞密度和优化过的感染条件。此外转染试剂很关键,建议用Lipo3000转染试剂。
Q14. 做病毒包装实验时,有时候做出来的病毒滴度很低,甚至不出毒,稳定性很差,为什么?
答:病毒包装涉及多个操作步骤,有几个方面需要注意:
1)不使用来源不清的质粒,尽量使用成熟稳定的商业化载体系统;
2)细胞培养和细胞转染时,需注意细胞密度是否适中和出毒期间细胞的活力;
3)按操作说明进行转染,注意排查质粒抽提纯化的异常情况以及目的基因的大小、序列和蛋白功能等情况是否对病毒包装产生影响。
Q15. AAV包装好之后,需要什么样的运输和保存条件?
答:AAV病毒包装好之后,用干冰运输寄送。使用时应避免反复冻融,根据实验需要适当分装于-80℃保存,可以保存一年左右;-20℃保存2周左右;4℃保存一周。
Q16. 如果不想做病毒包装实验这么麻烦,有什么解决方案吗?
答:病毒包装需要有昂贵的实验设备,操作步骤繁多,需要做质粒转染、细胞裂解、上清收集、病毒颗粒纯化和滴度纯度检测等多项质控,这些环节任何一个出问题都需要来回很长时间摸索验证。现在Scilia提供AAV病毒包装的一站式服务,您只需提供穿梭质粒或者所感兴趣的基因名字,选择做过表达还是做干扰表达,剩下的交给Scilia来帮您实现。Scilia将给您提供高质量高滴度的AAV病毒,您拿到病毒后,就可以尽快开始做下游的实验了。
小结:
接下来将继续分享总结AAV在科学研究领域的新进展,让大家了解更多实验知识避开不必要的坑,更高效顺利完成实验。最后,对AAV病毒包装实验有兴趣的小伙伴们欢迎大家一块沟通探讨。Scilia有项目经验丰富的专门团队和业内大咖给大家答疑解惑,助力您的科研项目。
该文章来自于网络转载,版权归原作者所有。如有涉及侵权请告知,我们将尽快删除相关内容。