支原体(mycoplasma)是一种大小仅为0.2~0.3 μm,没有细胞壁,能通过滤菌器(0.22-0.45 μm)、可用人工培养基培养增殖的较小原核细胞型微生物。在细胞培养过程中,支原体污染率达到60%以上,是细胞培养中令人头疼的大问题。当细胞(特别是传代细胞)被支原体污染后,细胞内的DNA、RNA及蛋白表达发生改变,污染严重时细胞生长缓慢,细胞形态发生改变,并出现细胞病变,且支原体感染不易察觉,由于支原体本身的特性,不易被清除,会导致实验研究中资金和人力的较大损失。
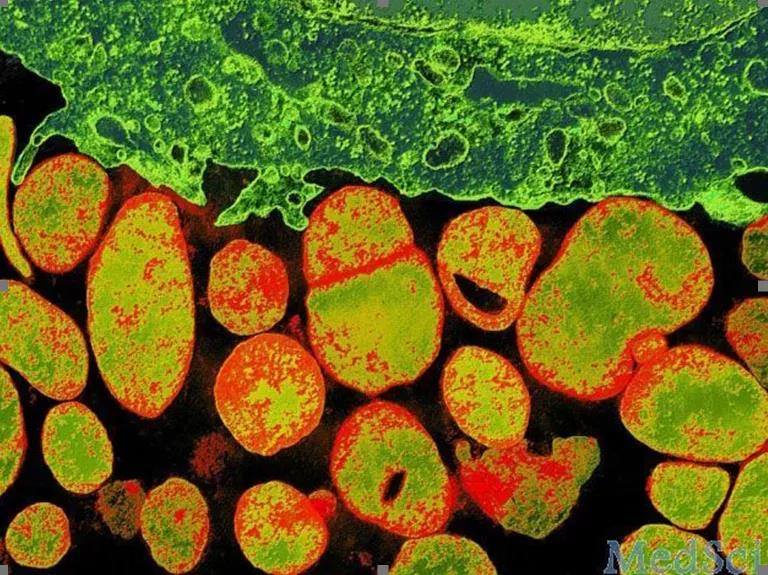
从2013年开始,业界顶级期刊《Nature》已正式要求投稿的文章如涉及细胞培养,都需要进行支原体检测,其它很多杂志,也纷纷效仿,提出了细胞实验中支原体检测的要求。 Mycoplasma (orange) can surround and infect cells and invalidate results of gene-expression studies. (Ewen Callaway, et al., Nature,2014)
Mycoplasma (orange) can surround and infect cells and invalidate results of gene-expression studies. (Ewen Callaway, et al., Nature,2014)
支原体污染的检测及鉴定
1. 分离培养法
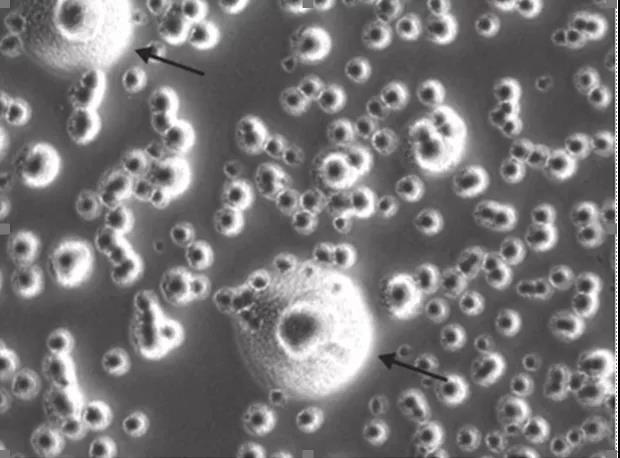
分离培养法是支原体检测的金标方法,其检测精确度较高。这种方法是从可疑的细胞培养体系中取样,并接种到最适宜支原体生长的琼脂平板上。如果样本中含有支原体,它们就会在这种琼脂平板上疯狂生长,最终形成明显可见的特征性菌落。分离培养法基本不会出现假阴性结果,因此被誉为支原体检测金标准。不过分离培养法检测时间太长,支原体要长出明显克隆至少需要4周时间,且有些支原体不能在培养基培养出来 (例如M. hyorhinis),所以该方法在常规的支原体检测中多用于辅助其它检测方法。
Typical Mycoplasma colony, having the classic ‘fried-egg’ morphology(Lesley Y oung , et al., Nat Protoc,2010)
2. 间接染色
在细胞培养中用荧光染料如Hoechst 33342或DAPI(4 ',6二氨基- 2 -苯基吲哚)染色可检测到支原体。Hoechst 33342荧光染料会结合到DNA的A-T富集区域,而支原体DNA中A-T含量占多数。在对支原体进行染色后,可见荧光小点或斑点,集中在细胞表面、周围培养基和培养皿上。相反,细胞核则呈现大的荧光椭圆形区域。
来源:ATCCAnimal Cell Culture Guide | ATCC
3. PCR检测
PCR法可以检测所有种类的菌株,包括M. hyorhinis菌株。该方法只需几个小时,是最灵敏的支原体检测方法。采用特异针对支原体的16S rRNA基因的保守区域的引物检测可疑样本,支原体DNA会显示为特异性条带,以此指示支原体的存在。缺点是不能区分支原体的死活,且因为PCR法过于灵敏,在操作过程中容易产生假阳性,所用的器具、枪头、管壁等也都可能因为携带微量的支原体DNA而导致假阳性现象,所以在使用该方法检测时一定要有阴性对照,避免环境中的污染影响结果。
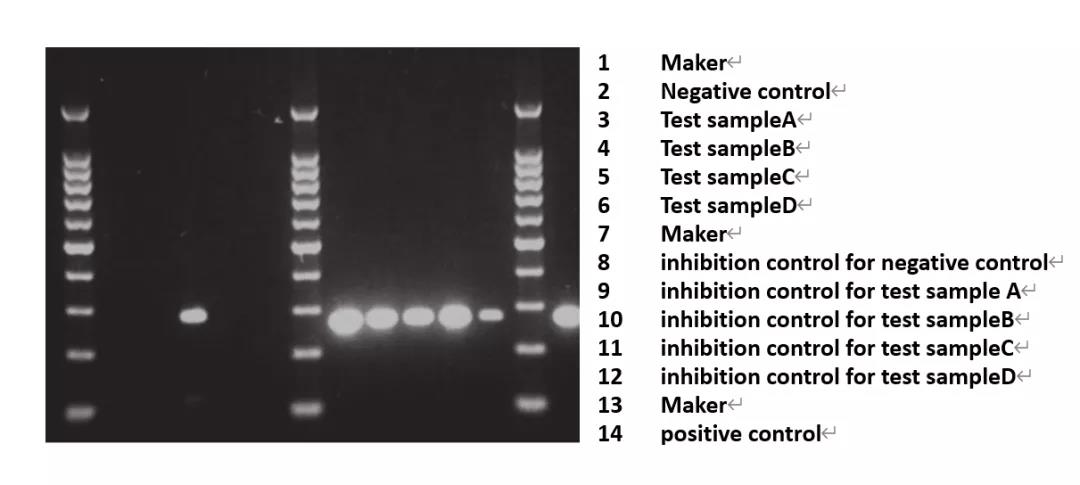 Typical gel photo from direct PCR(Lesley Y oung , et al., Nat Protoc,2010)
Typical gel photo from direct PCR(Lesley Y oung , et al., Nat Protoc,2010)
4. 酶学检测和ELISA
酶学检测是将可疑样本添加到特定底物中,在这一体系内支原体的酶可以将ADP转化为ATP,随后能利用ATP发光的luciferase酶就可以指示支原体的存在。ELISA也能用于支原体检测,以ELISA法为基础的支原体检测一般使用针对支原体16S rRNA基因的带标记探针或抗体,来检测培养物中是否含有支原体,现在针对该方法也研发了对应的检测灵敏度高的试剂盒,还可实现96孔板等高通量快速的检测,大大节约时间和成本。
5. 实时荧光恒温核酸检测技术(ERA)
其原理是实时荧光恒温核酸检测技术(ERA),可以在恒定的低温下(25℃-42℃)对痕量的支原体种内保守性DNA片段进行特异性的扩增,扩增反应可以在20min内完成,该试剂盒检测范围涵盖130种支原体,灵敏度也比较高,是普通PCR的10-1000倍,操作简便。缺点是该试剂盒需要借助荧光定量检测仪,仪器往往比较昂贵。
支原体污染后的清除策略
培养细胞一经污染,多数较难处理,如果污染细胞价值不大,可以选择丢弃,在寻找原因后彻底消毒操作室,复苏或重新购置细胞,再培养。若污染细胞价值较大,又很难重新得到,可采取如下办法清除支原体。
1. MRA处理:用支原体清除剂(Mycoplasma Removal Agent)处理细胞,如Plasmocin treatment,大概每4天还一次液,大概两周可以清除支原体。
2. 清洗纯化法:其原理是利用离心力、细胞、微生物质量和悬液的浮力差达到清除支原体的目的,支原体体积小且除发酵支原体外多为细胞外寄生,所以通过反复洗涤细胞和低速离心换液使其中潜在的支原体数量降低至极限. 若结合敏感抗生素的抑杀作用,可以达到更好的效果。
3. 支原体特异性血清:用5%的兔支原体免疫血清可去除支原体污染,因特异抗体可抑制支原体生长,故经抗血清处理后11天即转为阴性,并且5个月后仍为阴性。但此法比较麻烦,不如用抗生素方便、经济。
4. 支原体清除培养基:每2~3天更换新鲜培养液,期间要保持细胞密度适当,并更换新的培养器皿,3天之后,即可见明显清除效果;处理两周后,可以进行支原体检测,检测支原体是否杀灭完全;如果仍有支原体残留,可以考虑再处理一周;为避免细胞再次污染,以后每隔1个月进行支原体的常规检测,以确保没有新的支原体污染。
如何避免支原体污染
预防是防止细胞培养过程中发生污染的较好办法。只有预防工作做在前,才能将发生污染的可能性降到较小程度。
1. 保证清洁无菌的工作环境
常规清洗地面和台面;定期清洁水浴锅;CO2 培养箱定期清洗、消毒和擦拭;生物安全柜每次使用后清洁及消毒。
2. 试剂耗材灭菌消毒与保存
细胞培养所用各种溶液,耗材灭菌除菌要仔细,确保无菌污染。
3. 规范的无菌操作
工作开始要先用75%酒精消毒手部以及袖口、瓶口等;在进行多种细胞培养操作时,所用器具(如移液枪等)要严格区分;在进行换液或传代操作时,注射器和滴管不要触及细胞培养瓶瓶口,以免把细菌带到培养液中污染其他细胞。细胞培养实验室应制定严格的管理制度,按照规范的实验程序操作。
4. 合理利用抗生素
过度依赖抗生素会让人们忽略无菌操作,过度抗生素常也会导致耐药菌的产生。
5. 制定规范的制度
一般只允许相关人员才可进入细胞培养区,细胞培养区需和其他区域分开,且每个细胞培养区应布局合理,保证所需物品就近放置,在处理细胞时避免不必要的走动,细胞培养区应避免使用水池,从而避免微生物污染。
学会辨别和处理支原体污染是一项不可或缺的实验技能,希望大家在看完本文后结合自己实验操作,学会如何应对细胞支原体污染。
该文章来自于网络转载,版权归原作者所有。如有涉及侵权请告知,我们将尽快删除相关内容。