重组腺相关病毒(rAAVs)是临床前和临床研究中最常用的体内基因替代治疗和基因编辑载体,但在系统传递后对特定组织的选择性转导仍然是一个挑战。遗传性肌肉疾病会导致进行性肌肉萎缩,治疗选择很少且无法治愈。
以 CRISPR-Cas9 为代表的基因编辑技术是治疗遗传性疾病的革命性方法,这种方式理论上能够从源头上解决遗传疾病问题。但是,肌营养不良症的基因疗法一直面临着许多障碍,包括如何将基因疗法有效递送到全身肌肉中。由于使用天然的AAVs在全身注射后主要隔离在肝脏,需要高剂量的携带基因的病毒才能到达全身肌肉,而这会导致肝脏中的病毒载体含量过高,出现严重的不良副作用,甚至导致一些临床试验参与者的死亡。
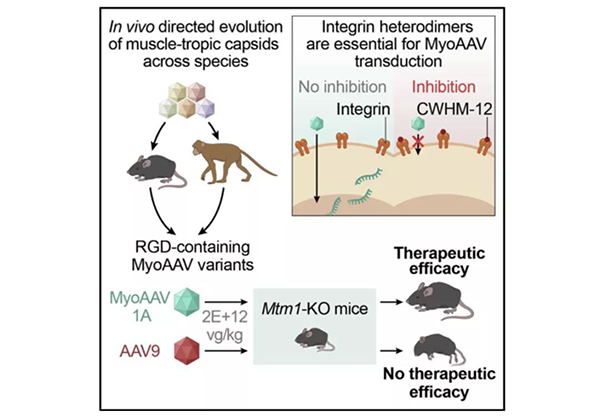
近日,美国布罗德研究所和哈佛大学等研究机构的研究人员发表在《Cell》上的一项题为“Directed evolution of a family of AAV capsid variants enabling potent muscle-directed gene delivery across species”的研究中,在小鼠和灵长类动物体内定向进化出一种工程化改造的AAV载体—MyoAAV,研究结果显示该载体能够高效靶向肌肉组织,递送到肌肉组织的效率是传统病毒载体的10倍以上,且该载体在遗传性肌肉疾病中的治疗剂量要比传统病毒载体降低大约100到250倍,这一成果极大地降低了肝脏损伤和其他严重副作用的风险。
定向进化新型AAV,让肌肉组织的基因治疗更高效更安全
DELIVER策略 — 新型AAV载体MyoAAV
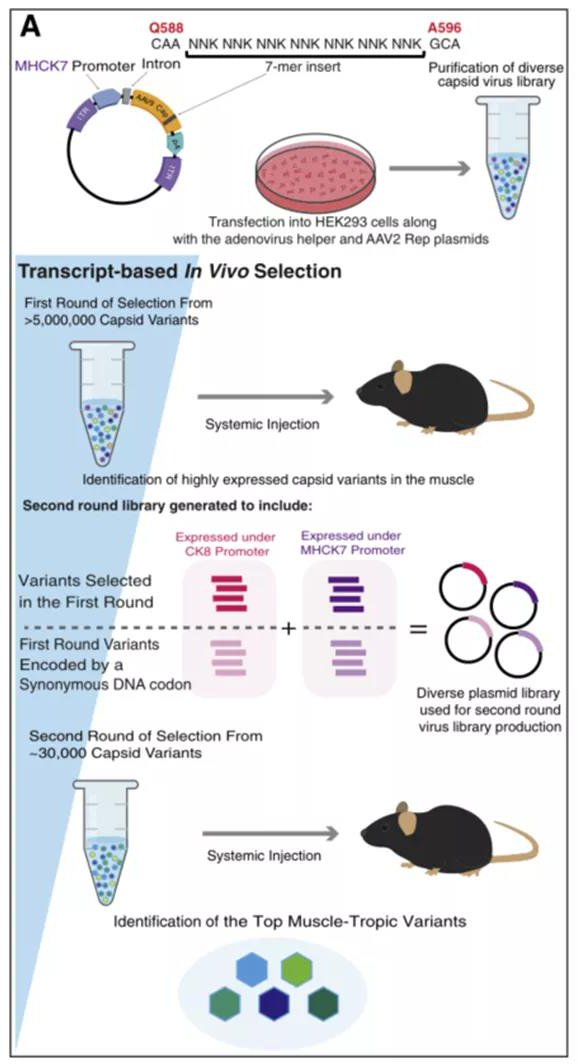
作者首先开发了DELIVER策略(利用转基因 RNA 的体内表达定向进化AAV衣壳)将多样化的衣壳文库生成与严格的基于转录本的体内选择相结合,从而实现定向进化,在任何感兴趣的组织和动物模型中鉴定功能性衣壳变体。
利用DELIVER技术生产病毒库和衣壳变异选择的示意图
本研究基于AAV9设计的衣壳库中,每个变体都包括一个随机的7聚体肽(7-mer peptide),插入到AAV9衣壳高变区VIII的第588位和596位氨基酸之间,这种设计可确保可变肽序列暴露在衣壳表面;每个变体还包含了在普遍存在或细胞类型特异性启动子控制下的编码自身衣壳的基因序列,使得衣壳变体可以在HEK293细胞和动物组织中表达。
通过两轮体内定向进化筛选,在C57BL/6J小鼠的多种不同肌肉组织中筛选出了由MHCK7启动子表达的衣壳变异体:第一轮病毒库测序分析确定了超过 5,000,000个独特的衣壳变体,通过筛选之后,在7种肌肉组织(股四头肌、胫前肌、腓肠肌、三头肌、腹部、膈肌和心脏)中选出高度表达的前30,000 个变异体;在第二轮筛选中,作者引入了两种对照,同义密码子和启动子(肌肉特异性启动子CK8或MHCK7),发现来自CK8或MHCK7文库在肌肉中高度表达的前12种衣壳变体在7聚体插入片段的前三个氨基酸位置包含相同的RGD基序。最后,选定包含RGDLTTP肽插入的变体进行进一步表征,并将该变体命名为“MyoAAV 1A”。
MyoAAV 1A系统给药后
能高效转导小鼠肌肉
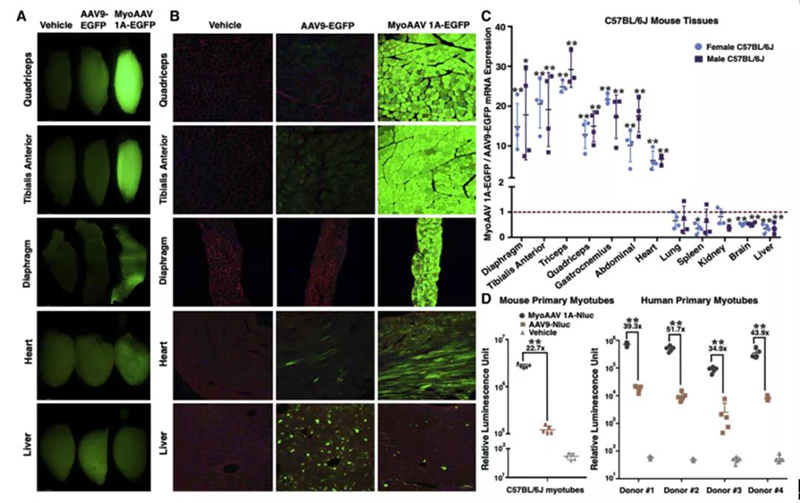
为了研究在全身给药后MyoAAV 1A的转导谱和生物分布,给成年C57BL/6J 小鼠注射了AAV9-或MyoAAV 1A-CMV-EGFP,并在2周后分析不同组织中的转基因表达和载体基因组丰度。组织荧光成像与免疫荧光分析结果均显示,与注射AAV9的小鼠相比较,注射了MyoAAV 1A的小鼠肌肉中的荧光强度更高;MyoAAV 1A注射小鼠肌肉纤维和心肌细胞中的转基因高表达;且MyoAAV 1A在肝脏滞留相对减少。通过对小鼠不同骨骼肌中EGFP mRNA的定量分析发现,与注射AAV9的小鼠相比,注射MyoAAV 1A的肌肉中转基因表达高 10至29倍;在注射了MyoAAV 1A的心脏组织中,EGFP mRNA表达量高6.3倍,肝脏中低2.8倍;这种进化的衣壳变体以更低的效率转导了注射动物的肺、肾、脾和脑。这些结果说明全身给药后,MyoAAV 1A可以特异性地高效地转导小鼠肌肉组织。
MyoAAV 1A在全身注射后能高效转导小鼠骨骼肌
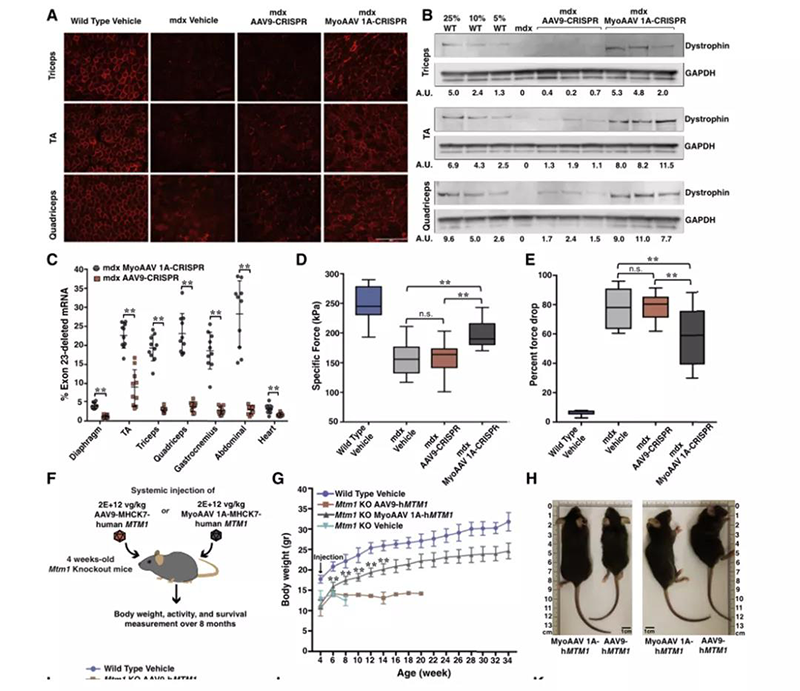
接着,作者使用MyoAAV 1A往体内递送基因编辑系统和治疗性转基因,在DMD和XLMTM小鼠模型中使用MyoAAV 1A后均表现出积极的效果。结果显示在DMD小鼠中,与AAV9载体相比,携带CRISPR-Cas9基因编辑系统的MyoAAV 1A小鼠体内SaCas9和gRNA表达量分别提高了6.7 ~ 19倍和3.5 ~ 7.8倍,23号外显子缺失效率也明显更高。在XLMTM小鼠模型中,经过MyoAAV 1A载体治疗后小鼠都存活下来,并表现出与正常小鼠接近的活动水平。
在DMD和XLMTM小鼠模型中
使用MyoAAV 1A后均表现出积极的效果
低剂量,极大降低肝脏损伤风险
在大型动物模型和人类患者中,肝脏是自然发生的AAV衣壳的主要转导位点,也是大剂量给药AAV载体相关的毒性靶点,所以想要达到治疗效果并避免对肝脏的损伤,一直是个极大地挑战,特别是两项基因治疗试验(临床试验标识符NCT03368742和NCT03199469)由于与肝毒性相关的严重不良反应而被FDA暂停临床试验。
本研究中作者通过DELIVER策略筛选出来的MyoAAV载体可有效避免病毒载体对肝脏的损伤,一是起到相同的治疗效果需要的MyoAAV剂量非常低,二是其不会在肝脏中滞留远少于传统载体。
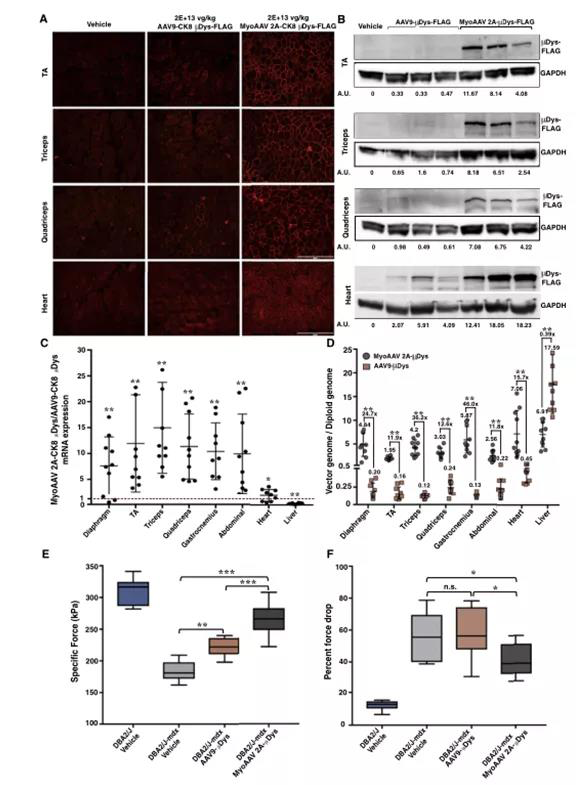
在MyoAAV 1A的研究基础上,作者又通过DELIVER平台筛选获得了二代载体MyoAAV 2A。MyoAAV 2A在注射低剂量病毒后显示出巨大的治疗潜力,使用比传统载体更低的量能达到更好的治疗效果,且在肝脏中的量要更低。
低剂量注射MyoAAV2A-CK8-微晶体蛋白后
引起小鼠体内微晶体蛋白的广泛表达并显著恢复肌肉功能
有望应用于 “任何” 组织
基于本篇文章的研究结果,作者认为DELIVER系统提供了一个高度适应性的平台,可用于识别体内任何组织或细胞类型的精确AAV衣壳变体,这可以极大地扩展该载体系统在各个领域和学科的临床和实验应用,并预计将DELIVER应用于其他组织和器官系统将对加速基因治疗和其他用于各种人类疾病的基因组医学方法的发展和转化产生深远的影响。
参阅文献
1. Mohammadsharif Tabebordbar et al.Directed evolution of a family of AAV capsid variants enabling potent muscle-directed gene delivery across species. Cell, 2021.
该文章来自于网络转载,版权归原作者所有。如有涉及侵权请告知,我们将尽快删除相关内容。